Единой трактовки патологических изменений в венах нижних конечностей нет. Это касается как макрогемодинамики, так и микроциркуляции, а также вариантов и последовательности гистохимических изменений.
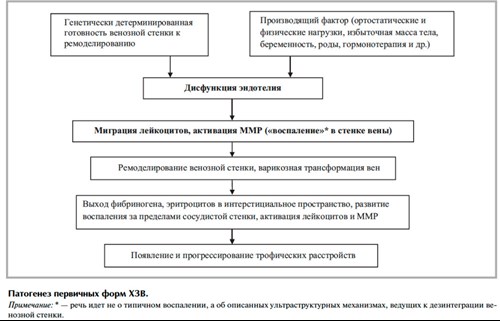
Генетический базис для варикозной трансформации до конца не ясен. Очевидно, важная роль принадлежит определенным генным мутациям, которые выступают в качестве неустранимого фактора риска первичного хронического заболевания вен (ХЗВ). Многочисленные события, происходящие в процессе формирования и манифестации ХЗВ, можно разделить на две большие группы − хроническое воспаление и изменение венозного оттока.
При гистологических и ультраструктурных исследованиях у больных с ХЗВ обнаруживают гипертрофию стенки варикозных вен с увеличением количества коллагена, а также одновременным нарушением архитектоники гладкомышечных клеток и эластиновых волокон. В культуре гладкомышечных клеток, полученных из стенки варикозной вены, отмечается нарушение синтеза коллагена с увеличением волокон I типа и уменьшением волокон III типа. Коллаген I типа обусловливает повышенную ригидность соединительной ткани с явлением остаточной деформации, коллаген III типа повышает ее эластичность с сохранением исходной формы. В стенке здоровой вены превалирует коллаген III типа. При варикозной болезни наблюдается увеличение коллагена I типа. Синтез коллагена III типа в культуре гладкомышечных клеток и фибробластов при варикозной болезни снижен, что подтверждает системность данного нарушения. Со временем разнонаправленные процессы синтеза и деградации приводят к появлению гипертрофированных и атрофированных сегментов вены.
Отмечающаяся при ХЗВ дисрегуляция синтеза коллагена снижает эластичность стенки вены и создает условия для ее пространственной деформации (варикозной трансформации). В стенке варикозных вен при этом отмечается чередование сегментов сосуда с гипертрофированной стенкой и атрофированных участков, включающих небольшое число гладкомышечных волокон и незначительное количество межклеточного вещества. Деградация протеинов, формирующих внеклеточный матрикс, происходит в результате воздействия протеолитических ферментов, синтезируемых эндотелиоцитами и макрофагами, в первую очередь, матриксных металлопротеиназ (MMP). При этом обнаруживается увеличение уровня цитокинов, в частности трансформирующего фактора роста фибробластов. Взаимодействие протеолитических энзимов, их ингибиторов и цитокинов позволяет понять механизм изменений в стенке варикозных вен, где обнаруживают большое количество мастоцитов, ферменты которых активируют MMP, разрушающие внеклеточный матрикс.
В настоящее время точно не известны все механизмы, вызывающие изменения в венозной стенке и клапанах. Важную роль в этом процессе играют гемодинамические характеристики кровотока, одной из которых служит изменение «силы сдвига». Длительный застой венозной крови приводит к растяжению стенки сосуда и деформации створок клапанов. Возникающий ретроградный кровоток снижает тангенциальное напряжение венозной стенки. Даже при отсутствии рефлюкса венозный стаз вызывает формирование на поверхности эндотелия зон с низкой или нулевой силой сдвига, что приводит к структурным изменениям венозной стенки. Все эти события, возможно, инициируют воспалительные реакции с участием лейкоцитов и эндотелиоцитов с последующими патологическими изменениями в венозной стенке и клапанах. Косвенным подтверждением участия лейкоцитов в процессе варикозной трансформации может служить их обнаружение в венозной стенке при гистохимических исследованиях.
При варикозной болезни (ВБ) наблюдается дисбаланс между MMP и их тканевыми ингибиторами (TIMP) в сочетании с прерыванием коллагеновых волокон, потерей эластина, а также пролиферацией, реорганизацией и миграцией гладкомышечных клеток в интиму. В стенках варикозно-расширенных вен гладкомышечные клетки теряют дифференцировку и способность к взаимодействию. Все эти феномены вносят вклад в дилатацию вен, релаксацию стенки и потерю венозного тонуса.
Описанные процессы в стенке вены могут являться пусковым моментом повреждения эндотелия, в результате чего запускается эндотелиальная и лейкоцитарная активация, являющаяся стартовой точкой венозного воспаления. Повторные эпизоды воспаления в эндотелии приводят к хроническому рецидивирующему повреждению венозной стенки, что поддерживает воспалительное состояние на уровне вены.
Воспаление не является ключевым фактором развития ХЗВ и ВБ, но может нарушать нормальную функцию клапанов вен, что подтверждает инфильтрация недостаточных клапанов большой подкожной вены моноцитами уже на ранних стадиях ВБ. Наряду с этим, в анализах крови из вен нижних конечностей обнаруживают свободные радикалы и активированные лейкоциты, количество которых непосредственно связано со стадией заболевания.
Синтез MMP и TIMP происходит у всех пациентов в зоне нарушенной трофики. Их соотношение и роль в патологическом процессе до конца не ясны. Синтез ММP увеличивается в результате стаза крови. Непосредственно вокруг трофической язвы синтезируется ММР-9, а в самих, обычно не заживающих венозных трофических язвах, обнаружены ММР-1 и ММР-8. При этом отмечено уменьшение количества ингибитора TIMP-1.
Трофические нарушения кожи у больных ХЗВ связаны с воспалением. Экстравазация макромолекул (фибриногена и альфа2-макроглобулина) и эритроцитов в интерстициальные ткани приводит к их разрушению. Продукты разрушения обладают мощным хемотаксическим эффектом, что формирует первоначальный сигнал хронического воспаления. При липодерматосклерозе и венозных язвах отмечено увеличение синтеза и наибольшей активности металлопротеиназ (в особенности ММР-2). Высокий уровень ММР обнаружен и в экссудате из активных язв. Концентрация TIMP-2 при липодерматосклерозе и венозных язвах ниже. Неконтролируемая активность ММР при хронической патологии вен приводит к разрушению внеклеточного матрикса и образованию венозных язв, а также препятствует их заживлению.
Важное значение в прогрессировании клинической симптоматики ХЗВ придается механизму так называемой лейкоцитарной агрессии. Под воздействием венозного стаза происходит активация лейкоцитов в посткапиллярных венулах, их фиксация к эндотелиоцитам и выход в паравазальное пространство. Это подтверждается результатами иммунохимических и ультраструктурных исследований, а также увеличением уровня активатора плазминогена. Следующим этапом является развитие фибросклероза под контролем трансформирующего фактора роста-бета1 — хорошо известного стимулятора фиброза. Активированные лейкоциты, выходя в окружающие ткани, стимулируют синтез фибробластами компонентов соединительной ткани. Их количество (относительно эритроцитов) в венозном русле пораженной конечности значительно выше, чем в контралатеральной.
Для ХЗВ характерен каскад воспалительных реакций в мягких тканях нижних конечностей. На первом этапе развивается липодерматосклероз, при котором на фоне сохраненной архитектоники мягких тканей микроскопически определяется увеличение площади капиллярного русла не за счет увеличения их абсолютного числа, а в результате их удлинения и извитости. Микроскопически это проявляется инфильтрацией сосочкового слоя кожи моноцитами, макрофагами, соединительнотканными протеинами и фибрином, который концентрируется вокруг капилляров в виде «манжетки». В небольших количествах обнаруживают Т-лимфоциты и молекулы межклеточной адгезии-1 (ICAM-1). В этой стадии начинает вырабатываться сосудистый эндотелиальный фактор роста (VEGF), который приводит к увеличению проницаемости капилляров и неоваскуляризации. Средний уровень VEGF у пациентов с С3—С4 достоверно выше, чем у здоровых людей (контрольная группа).
ХЗВ вызывают персистирующий венозный стаз в результате недостаточного опорожнения вен нижних конечностей. При выраженной картине венозного застоя присоединяются и клинические проявления нарушения лимфатического оттока, что позволяет говорить о лимфовенозной недостаточности.
Патогенез варикозной трансформации вен является комплексным и мультифакториальным процессом. Хотя общие проявления ХЗВ прежде всего связаны с клинической манифестацией и лабораторным подтверждением дисфункции венозных клапанов с развитием патологического рефлюкса, в настоящее время наибольшее количество сторонников имеет теория вторичности клапанной несостоятельности к имеющемуся при ХЗВ повреждению венозной стенки.
Особенности патогенеза вторичных форм ХЗВ связаны с последствиями острого венозного тромбоза, а также с патологическими состояниями, приводящими к нарушению венозного оттока (застойная сердечная недостаточность, сдавление извне, морбидное ожирение, заболевания опорно-двигательного аппарата и др.).